综述: 内镜黏膜下层剥离术(ESD)和内镜下黏膜切除术(EMR)
引言
内镜黏膜切除术(EMR)和内镜黏膜下层剥离术(ESD)见证了内镜技术从疾病诊断技术,发展成治疗胃肠道黏膜病变及早期癌症有效手段的历程。EMR是息肉切除技术,特别是带蒂息肉切除技术的延伸,适应于无柄及横向扩散的病灶。EMR和ESD的区别在于黏膜下注射使病变黏膜隆起形成新息肉或者假息肉,从而增加套圈器对病变组织的圈取。黏膜下注射技术引入于1955—1973年,用于硬性及灵活性结肠镜检查[1,2]。自此之后,EMR技术发展衍生出不同方法,主要有注射辅助式、帽吸引式及结扎式。EMR技术可通过分段切除实现对病灶组织的完全切除。
为了对比EMR和ESD,有必要充分了解胃肠壁层解剖学上的精细结构。由胚胎内胚层发育而成的黏膜层和胚胎中胚层起源的肌肉层是胃肠道层两种最主要的结构分层,彼此间通过松散结缔组织构成的黏膜下层相连接[1]。EMR和ESD均涉及到在黏膜下层区域将黏膜层和肌肉层分离的过程。标本组织学评价显示ESD切除的最大组织深度相比于EMR要稍大,表明ESD在黏膜下层的分离要更深[3]。从病理学角度看,ESD可以一次性完整切除较大面积病变组织,对肿瘤切除更有利。但ESD的潜在风险是术中出血率较高,尤其是当黏膜下层较深部位有壁内血管经过的区域。电外科设备及凝血发生器的发展促进了ESD技术的改进。
亚洲胃癌发生率比欧洲和美国高8~10倍,这使得ESD技术在亚洲被快速推广。一些国家将ESD列入国家筛查项目,使得ESD得到发展,有助于发现大量癌前病变及早期胃癌。ESD的适应证已扩展至早期淋巴结常出现转移的食管肿瘤,若对早期食管肿瘤实施手术切除会恶化病情。后来ESD也适应于结肠和直肠肿瘤,这也是ESD在欧洲和美国普及的主要动力。
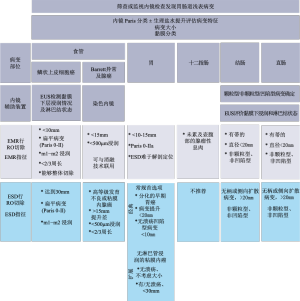
EMR和ESD技术在靶向病变及疑似病灶的解剖分层定位如图1所示。虽然有少部分针对治疗良性病变的适应证,但现有数据表明EMR和ESD的适应证大多数为癌前病变及早期恶性肿瘤。EMR和(或)ESD可用于治疗食管上皮化生和异型增生(巴雷特食管)、某些早期胃癌和一些不涉及壶腹部的十二指肠浅表病变。十二指肠以外的小肠病变很少能通过内镜成功切除。结肠及直肠息肉、早期癌症等可以通过EMR和(或)ESD得到控制。
患者的选择和检测
实施EMR和ESD前对患者的选择至关重要,采用EMR还是ESD,主要取决于胃肠道病变部位的表面形态。不恰当的EMR或ESD会导致肿瘤不完全切除、必须手术干预治疗等,将影响整体预后。通常,EMR适应于整个胃肠道所有良性的及癌前的病变,而ESD的适应证需要细分,简列如下。
食管
淋巴浸润肌层黏膜的食管癌,相比于其他胃肠道肿瘤,更容易出现早期淋巴结转移。因为食管切除术有较高的致病率和致死率,内镜下切除癌前病变和早期恶性病变具有较大优势,使得患者免于食管切除术。对于上皮化生及发育不良的巴雷特食管,EMR是众多根治方法中的一种。EMR能够完全切除巴雷特食管病变,大多数内镜医生会采用EMR去清除巴雷特食管部位明显的结节。同时结合热消融疗法或射频消融疗法,进行安全有效地根除[4]。此外,EMR还用于治疗黏膜层或固有层部位早期中分化和高分化的食管鳞状细胞癌[5]。一般来说,EMR可接受病变的最大直径为2~3cm,并且小于食管腔周长的1/3[3,4]。超出这个范围,则容易出现穿孔、切除不完全及晚期狭窄。ESD适用于大小相似、占食管腔2/3以下的病变。根据内镜超声评估,浸润深度小于200 µm的癌症,有尝试ESD的相对指征[6]。采用EMR还是采用ESD实现早期食管癌R0成功切除,需要根据病变潜在表型(鳞状细胞癌还是腺癌)判断,目前暂未达成共识[7,8]。
胃癌
日本早期胃癌发病率最高,EMR和ESD是治疗早期胃癌的主要方式。超过50%的胃癌在早期即被诊断出来,常采用内镜方式治疗[6]。ESD和EMR在治疗胃癌方面均安全有效。文献报道EMR治疗胃癌后的复发率为6%~10%,相比分块切除略高。ESD后的复发率为1%,为亚洲地区首选内镜方式。ESD能够明确界定病变部位边缘状态,更利于整块切除。然而,与EMR相比,胃ESD手术时间更长,故对于有明显共病的患者更倾向于应用EMR。一般情况下,EMR或ESD适应的病变多为中分化或高分化、无溃疡、直径小于2 cm的腺癌和乳头状癌。扩展标准强调扁平型或凹陷型,胃部病变最大直径限制为1 cm。低分化的腺癌及印戒细胞癌多与早期淋巴结转移有关,故不考虑采用EMR或ESD。
十二指肠
某些情况下,偶发性和未累及壶腹部的十二指肠腺瘤通过EMR可以成功治疗,值得注意的是,关于EMR在此部位的文献报道均来自于大样本中心[9,10]。采用十二指肠镜检查评估是否累及壶腹部非常必要。此部位EMR的出血及穿孔率稍高,需对患者进行夜间观察。
结肠和直肠
EMR在结肠和直肠中应用广泛,对于较大、无蒂病变能够成功实现治疗性切除。EMR适应于直径20 mm或更大的无蒂息肉,有些情况下EMR能够切除的病变可达40 mm。分段切除、同位置预先干预及解剖位置不便等均是造成EMR失败的潜在因素[4]。ESD一般具有相似指征,但对治疗目的及病变边缘状态更加重视。若有任何问题,有必要参考外科切除标准。
术前准备
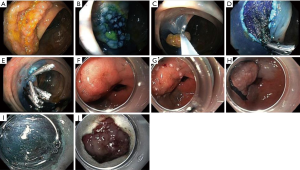
EMR或ESD实施前大部分术者会用内镜检查。不仅能仔细检查,作为知情同意一部分,还能为术者提供充足的讨论过程。对靶病变进行目视检查,并根据Paris等级进行分类[11]。凹陷及溃疡病变更可能与黏膜下浸润相关,需进行活检、标记及手术切除。需要注意的是,那些预先干预的病灶,因为瘢痕和纤维化的缘故也会造成病变凹陷。若最初目视检查不清楚,大多内镜医生会注射生理盐水使病变区域隆起,再对病灶进行特征评估(图2)。无法隆起的病灶常意味着更深的浸润,应进行手术切除。无论是否采用局部染色增强病灶,亚洲地区普遍会对病灶表面结构及隐窝形态进行放大成像,但由于放大式内镜缺少,此法在西方未能普及。其他辅助装置,如内镜超声能更好地确保内镜切除病灶的准确性。病灶标记也非常有用,但不能标记在靶病灶上,否则会造成组织纤维化。
合理镇静、麻醉及共病管理对手术有益。在美国,大多数内镜手术中联用苯二氮和麻醉剂,如咪达唑仑和芬太尼,以达到中度镇静效果。异丙酚也可能适用,我们证实,在任何领域非麻醉师不能使用异丙酚,使用时需额外培训,同时需要患者监测设备[12]。两种麻醉方式对EMR都适用,但是对于偶尔手术时间较长的ESD来说推荐全身麻醉。实施EMR或ESD前,应对心脏和呼吸系统合并症进行评估,需要全身麻醉的患者尤其需要行此评估。出血是EMR和ESD主要并发症,使用抗凝及抗血小板药物的患者出血风险更高。应遵循抗凝和抗血小板药物围手术期管理的标准方案[13]。
病变切除前充分肠道准备对病变检测及病变可视化至关重要。对于食管和胃损伤,术前1天清流质饮食,术前6小时禁食禁饮能有效预防食管及胃功能紊乱。对于结肠和直肠病变,首选聚乙二醇肠道清洁准备。若准备不足,EMR或ESD手术则不能进行。此情况需进行二次肠道准备,重新安排患者在次日手术。
除了患者评估、准备和优化外,还需要考虑术者的准备。在西方ESD正被慢慢采用,但技术熟练或经验丰富的高级内镜师极其短缺。最后,大多数恶性疾病的治疗过程反映了多学科管理模式,需要与胸外科、普通外科、结直肠外科及内科肿瘤学相关专家建立良好的沟通。
设备首选标准
- 具有视频监控和灌洗系统的治疗性全内镜。视频录制功能对EMR或ESD学习非常有用。
- 电外科发电机能实现EMR和ESD自定义设置。我们机构使用Erbe Vio® 300D(Erbe USA,玛丽埃塔,佐治亚州,美国),配备喷水和氩等离子凝固器(APC)模块及脚踏板。
- 二氧化碳注入系统。
- 基于EMR:
- iSnare System®(US 内镜,门托市,俄亥俄州,美国);
- 食管病变,使用Duette®多带黏膜切除工具包(Cook Medical,布卢明顿,印第安纳州,美国);
- Roth Net®(US内镜,门托市,俄亥俄州,美国);
- 各种止血夹。
- 基于ESD:
- 各种注射针和注射溶液;
- 使用直盖和斜盖;
- APC™ 2 (Erbe USA, 玛丽埃塔, 佐治亚州, 美国);
- DualKnife™ (奥林巴斯内镜,中央谷, 宾夕法尼亚州, 美国);
- ITknife nano™ (奥林巴斯内镜,中央谷, 宾夕法尼亚州, 美国);
- 各种止血夹。
手术过程
EMR或ESD在专用内镜设备下进行。EMR常使用苯二氮卓达到中度麻醉镇静,而ESD因手术过程较长更倾向使用全身麻醉。EMR发生菌血症的概率较低,故大多数医疗机构围手术期不使用抗生素[14]。一旦定位病变部位,稳定的入口通道和视野至关重要。研究人员在电外科设备结合不同电外科发射器的相关设置及脉冲波模方面式也做了大量工作,但不在本综述讨论范围[15]。
EMR
无论采用何种技术,EMR的前两个步骤都是定位病变部位,并进行黏膜下注射。注射用21-25g针头完成,以形成新息肉(图2)。为实现相对均匀的隆起,需要多次注射。根据病变位置不同,有多种注射溶液可供选择。少量研究进行了注射溶液隆起的比较,但注射溶液的选择主要取决于个人偏好[10,16]。通常,黏性越强的注射溶液产生的隆起持续越久。注射溶液中添加靛蓝胭脂红或亚甲基蓝有助于识别黏膜下层,更重要的是帮助识别靶病变侧缘。病灶切除可通过单次切除完成,若病灶较大分块切除也可实施。可通过以下任意技术完成切除。
套圈法
通过内镜的工作通道引入一个比靶病灶稍大的热套圈。黏膜下注射通常可以在病变远边缘有更大的组织覆盖。病灶包围后,设置套圈,同时确保组织没有太多聚集。最后采用电灼术清除病灶。如果需要分块切除,上述步骤可以连续重复。
抽吸或帽式EMR
此技术使用时需在内镜末端加上一个透明塑料帽子。帽子放置恰当后行黏膜下注射。将帽子贴在组织上,进行抽吸,在帽子内形成新隆起。然后放置热套圈,一般沿着帽子外周放置。最后采用电灼术清除抽吸范围内的病灶。对于小的病灶,套圈应置于抽吸管内。应在吸引管中放置陷阱。抽吸帽技术在胃和食管病变切除中最有用。
结扎式
此技术使用在内镜末端附带有带结扎系统的透明塑料帽。帽子放置恰当后行黏膜下注射。再次抽吸将组织提升进帽内。然后展开束带。然后通过器械口放置热套圈,用于切除隆起病灶。套圈套可以用在带的下面、对面或上面。有些术者在使用这项技术前不进行黏膜下注射。
ESD
ESD与EMR的起始操作相似,只是病灶定位。在进行下个操作之前保证病灶部位视野足够清楚也至关重要。有些时候,病变在反曲视图下更容易被发现,这种情况下,可采用儿童直径内镜,然而,狭窄口径内镜硬度降低,会使切除术更具挑战性。基于ESD的治疗性,确定病变侧缘极为重要(图2)。同时,表面染料、色素内镜、窄带成像、显影或其他辅助手段的使用也很重要,但不在本综述讨论范围。下一步采用针刀或APC进行环周黏膜标记。胃病变标记在病变外侧缘外约5 mm处。食管腺癌的标记在病变外缘5~10 mm处,鳞癌标记在病变边缘处。结肠病变的边界通常较明显,不需要标记。在黏膜标记处做一个环周黏膜切口。然后用21-25g针进行黏膜下注射以隆起病变。最后在帽子和ESD专用刀的辅助下进行黏膜下剥离。在帽的远端抬高病变,电手术刀平行于肌层剥离病变。任何出血都应迅速控制,因为血液会迅速遮盖剥离面。继续黏膜下剥离,直到病灶完全游离。小的病变通常可以通过帽吸出,而较大的病变可能需要呼吸道异物清除取石网篮(Roth Net®)。一般情况下,最好将病灶定位于5点钟位置,可以使手术可操作性及手术视野达到最佳。如果可能的话,调整患者使病变置于反依赖的位置,利用重力帮助收缩[3]。
术后管理
与大多数内镜手术一样,大多数患者术后可以回家。住院治疗只是例外而不是普遍现象。几乎所有的EMR操作都可以作为流动程序执行。与EMR相比,ESD具有更高的出血并发症风险,因此,需要过夜观察。对于ESD新手的术者尤其如此。
在术后即刻期,监测重点是发现EMR或ESD的早期并发症。出血是最常见的并发症。EMR后食管出血很少见,但大约0~11%的胃病变和2%~22%的结肠病变会发生出血[10]。大多数出血事件发生在手术寻找病变位置过程中,绝大多数手术后出血发生在24小时内;然而,延迟出血的发生率可达5%[10]。对可见的非出血血管进行预防性凝血并不能减少EMR术后出血。ESD后出血也很常见,发生率为4.5%~15.6%,这种风险随病变大小而增加或减少[17]。因此鼓励谨慎的处理术中止血。胃和十二指肠病变,质子泵抑制药和黏膜保护剂与出血率降低有关。值得庆幸的是,EMR和ESD术后穿孔并不常见。EMR穿孔发生率为0.5%~1%,由于位置不同会有一定的变化,这反映了胃肠壁厚度的差异。ESD的穿孔率较高,可达2%~4%。ESD使用的刀具尺寸越小,穿孔率越低。黏膜肌层聚集到套圈中造成EMR穿孔较大。若在寻找病灶过程中造成穿孔,可在内镜下使用夹子及缝线缝合处理,或经皮引流、腹腔或胸腔外科探查处理。
EMR或ESD术后,内镜检查非常必要,便于监测复发和新病变,同时评估狭窄。对于内镜检查的时间间隔没有共识,但前期诊断大多在术后3~6个月是必要的。EMR和ESD相关狭窄在食管中最常见,发生率12%~17%[10,17]。这些症状通常可以通过气囊扩张来缓解。令人遗憾的是,顽固性狭窄可能需要手术干预。
提示、技巧和误区
ESD需要大量学习,尽管它确实取决于内镜医生的个人背景。在亚洲的训练范式中,经过30~40次ESD程序后,受试者对ESD的熟练程度已达到可独立操作的水平。>80例(18~20例)手术比较显示,受训者手术结果与专家相似。由于这个原因,培训最好在三级中心进行,因为那里存在大量需要手术修复病变的患者。
一些作者提出了对亚洲以外的内镜医生进行培训以获得必要的技能及安全执行ESD的资格[6,21]。这些作者提倡去亚洲大型医疗中心初步观摩和培训。培训需要在动物模型(通常是猪或狗)的体外和体内进行专门训练。初次尝试ESD应由经验丰富的内镜医生指导。虽然基于视频指导的ESD学习在国际上越来越多,但不适用于ESD新手,最好在新手内镜医生完成几例ESD操作后再通过视频学习,同时还要有能立刻救场且经验丰富的内镜医生在场[22]。
作者还注意到,ESD的操作因解剖位置而异。胃远端病变在技术上比较容易,其次是胃近端病变。这些病变在西方的发生率较低,但胃近端病变与结肠病变有共性,所以胃近端病变成为西方医生实施ESD最具吸引力的切入点[6]。
Acknowledgments
Funding: None.
Footnote
Conflicts of Interest: Both authors have completed the ICMJE uniform disclosure form (available at http://dx.doi.org/10.21037/ales.2016.11.11). The authors have no conflicts of interest to declare.
Ethical Statement: The authors are accountable for all aspects of the work in ensuring that questions related to the accuracy or integrity of any part of the work are appropriately investigated and resolved.
Open Access Statement: This is an Open Access article distributed in accordance with the Creative Commons Attribution-NonCommercial-NoDerivs 4.0 International License (CC BY-NC-ND 4.0), which permits the non-commercial replication and distribution of the article with the strict proviso that no changes or edits are made and the original work is properly cited (including links to both the formal publication through the relevant DOI and the license). See: https://creativecommons.org/licenses/by-nc-nd/4.0/.
References
- Rosenberg N. Submucosal saline wheal as safety factor in fulguration or rectal and sigmoidal polypi. AMA Arch Surg 1955;70:120-2. [Crossref] [PubMed]
- Deyhle P, Jenny S, Fumagalli I. Endoscopic polypectomy in the proximal colon. A diagnostic, therapeutic (and preventive?) intervention. Dtsch Med Wochenschr 1973;98:219-20. [Crossref] [PubMed]
- Saunders BP, Tsiamoulos ZP. Endoscopic mucosal resection and endoscopic submucosal dissection of large colonic polyps. Nat Rev Gastroenterol Hepatol 2016;13:486-96. [Crossref] [PubMed]
- Chandrasekhara V, Ginsberg GG. Endoscopic mucosal resection: not your father's polypectomy anymore. Gastroenterology 2011;141:42-9. [Crossref] [PubMed]
- Kodama M, Kakegawa T. Treatment of superficial cancer of the esophagus: a summary of responses to a questionnaire on superficial cancer of the esophagus in Japan. Surgery 1998;123:432-9. [Crossref] [PubMed]
- Bhatt A, Abe S, Kumaravel A, et al. Indications and Techniques for Endoscopic Submucosal Dissection. Am J Gastroenterol 2015;110:784-91. [Crossref] [PubMed]
- Huntington JT, Walker JP, Meara MP, et al. Endoscopic mucosal resection for staging and treatment of early esophageal carcinoma: a single institution experience. Surg Endosc 2015;29:2121-5. [Crossref] [PubMed]
- Small AJ, Sutherland SE, Hightower JS, et al. Comparative risk of recurrence of dysplasia and carcinoma after endoluminal eradication therapy of high-grade dysplasia versus intramucosal carcinoma in Barrett's esophagus. Gastrointest Endosc 2015;81:1158-66.e1-4.
- Kedia P, Brensinger C, Ginsberg G. Endoscopic predictors of successful endoluminal eradication in sporadic duodenal adenomas and its acute complications. Gastrointest Endosc 2010;72:1297-301. [Crossref] [PubMed]
- ASGE Technology Committee. Endoscopic mucosal resection. Gastrointest Endosc 2015;82:215-26. [Crossref] [PubMed]
- Endoscopic Classification Review Group. Update on the paris classification of superficial neoplastic lesions in the digestive tract. Endoscopy 2005;37:570-8. [Crossref] [PubMed]
- Vargo JJ, Cohen LB, Rex DK, et al. Position statement: nonanesthesiologist administration of propofol for GI endoscopy. Gastrointest Endosc 2009;70:1053-9. [Crossref] [PubMed]
- ASGE Standards of Practice Committee. The management of antithrombotic agents for patients undergoing GI endoscopy. Gastrointest Endosc 2016;83:3-16. [Crossref] [PubMed]
- Lee TH, Hsueh PR, Yeh WC, et al. Low frequency of bacteremia after endoscopic mucosal resection. Gastrointest Endosc 2000;52:223-5. [Crossref] [PubMed]
- ASGE Technology Committee. Electrosurgical generators. Gastrointest Endosc 2013;78:197-208. [Crossref] [PubMed]
- Fujishiro M, Yahagi N, Kashimura K, et al. Comparison of various submucosal injection solutions for maintaining mucosal elevation during endoscopic mucosal resection. Endoscopy 2004;36:579-83. [Crossref] [PubMed]
- ASGE Technology Committee. Endoscopic submucosal dissection. Gastrointest Endosc 2015;81:1311-25. [Crossref] [PubMed]
- Gotoda T, Friedland S, Hamanaka H, et al. A learning curve for advanced endoscopic resection. Gastrointest Endosc 2005;62:866-7. [Crossref] [PubMed]
- Oda I, Odagaki T, Suzuki H, et al. Learning curve for endoscopic submucosal dissection of early gastric cancer based on trainee experience. Dig Endosc 2012;24:129-32. [Crossref] [PubMed]
- Pimentel-Nunes P, Dinis-Ribeiro M, Ponchon T, et al. Endoscopic submucosal dissection: European Society of Gastrointestinal Endoscopy (ESGE) Guideline. Endoscopy 2015;47:829-54. [Crossref] [PubMed]
- Draganov PV, Gotoda T, Chavalitdhamrong D, et al. Techniques of endoscopic submucosal dissection: application for the Western endoscopist? Gastrointest Endosc 2013;78:677-88. [Crossref] [PubMed]
- Bhatt A, Abe S, Kumaravel A, et al. Video-based supervision for training of endoscopic submucosal dissection. Endoscopy 2016;48:711-6. [Crossref] [PubMed]
(本译文仅供学术交流,实际内容请以英文原文为准。)
Cite this article as: Strong AT, Ponsky JL. Review: endoscopic submucosal dissection (ESD) and endoscopic mucosal resection (EMR). Ann Laparosc Endosc Surg 2016;1:44.