肥胖症与代谢病手术的定义和适应证
简介
空肠旁路手术(Jejunoileal bypass,JIB)出现于20世纪50年代,是肥胖与代谢病手术最早的术式,被认为是肥胖和血脂异常的有效治疗方法。在这些早期手术中,通过吻合近端空肠段和远端回肠段而旷置了大部分小肠[1]。尽管后期对该术式进行修正,但由于JIB术后会发生严重的代谢性并发症导致吸收不良,该手术始终具有争议且未得到公认。1966年,梅森医生完成了第一例胃旁路手术,包括胃水平横断术和袢式回肠造口术[2]。然而,由于术后出现各种并发症,主要是胆汁反流,该手术逐渐演变成目前使用多年的标准术式,即Roux-en-Y吻合术[3-5]。
限制性手术的术式从胃间隔捆扎术发展为20世纪90年代非常流行的胃束带术[6,7]。关于不同类型的手术及其总体效果有较多争论,目前仍有关于限制性手术和吸收不良手术的讨论,但近期一些外科医生呼吁不应将手术分成限制性和(或)吸收不良两种类型。
最近的研究表明,肥胖与代谢病外科手术不仅单纯用于减重,术后早期可通过调节多种激素途径改善代谢紊乱,特别是出现了与减重无关的降糖效果[8]。回顾过去,正是早期对代谢紊乱的积极作用推动了减重手术的发展;然而,术后中长期的并发症,如吸收不良,促使研究人员和外科医生进一步寻求并发症更少的改良术式。
目前公认的术式,如袖状胃切除术(sleeve gastrectomy,SG)、胃旁路术等,有望以最少的并发症实现最优的减重与代谢调节效果,并得到近期的高质量临床研究和肥胖与代谢病学会指南的推荐。目前指南推荐在轻度肥胖和未控制的2型糖尿病(Type 2 Diabetes Mellitus,T2DM)患者中使用代谢病手术[9,10]。
肥胖症与代谢病手术的定义
流行病学
肥胖是全世界主要的公共健康问题之一,影响来自不同社会环境、经济水平和文化背景下的全年龄段人群。全球范围内,肥胖和与肥胖相关的慢性病(包括心血管疾病、糖尿病、代谢综合征和癌症)发病率逐年增加。1980—2013年的全球健康数据显示,与肥胖相关的死亡人数是与营养不良和饥饿相关死亡人数的三倍[11]。
世界卫生组织(World Health Organization,WHO)在2016年进行的一项综合研究表明:身体质量指数值(Body Mass Index,BMI)> 25 kg/m2的成年人(18岁以上)中有39%的人“超重”;而BMI>30 kg/m2的男性和女性中分别有11%和15%为“肥胖”。同时,18%的儿童和青少年超重或肥胖。在过去的25年中,肥胖症患者数量急剧增加,占全球人口的10%以上,并诞生“全球肥胖”的概念,可见其对全球健康的威胁[12]。
随着肥胖率的上升,每年的肥胖症手术也在增加。2013年国际肥胖症与代谢病外科联合会(International Federation of the Surgery of Obesity and Metabolic Diseases,IFSO)的调查表明,全世界完成的减重手术共468 609例,其中Roux-en-Y胃旁路术(Rouxen-Y gastric bypass,RYGB)占45%,其次是SG,占37%;然而,SG是北美最常用的术式[13]。根据美国肥胖症与代谢病外科学会(American Society of Bariatric and Metabolic Surgery,ASMBS)的数据,SG手术占全美2016和2017年所有减重手术的近60%;而在2011—2017年间,RYGB的占比从35%降至18%[14]。
外科术式
SG
SG是一种通过切除约80%的胃,且残余胃呈香蕉袖套样缝合的手术。
SG在技术上较其他吸收不良手术更简单,且术后一月内的主要并发症较少[15]。ASMBS推荐SG为限期患者的首选术式,但有关该术式的具体操作及长期预后仍需进一步研究。由于SG是一种限制性手术,术后腔内压力增加,因此术前合并胃食管反流的患者需谨慎选择SG;此外,大量证据表明SG可导致术后反流[16,17]。因此,虽然反流不是SG的绝对禁忌证,但术前合并反流的患者应首选RYGB手术。RYGB被认为可有效缓解胃食管反流症状[18,19]。
多余体重减轻(excess weight loss,EWL)率显著下降是影响SG长期预后的另一问题,可导致体重反弹(EWL从术后80%降至5年的50%~60%),且5年内糖尿病缓解率仅20%[20-21]。而在吸收不良手术中,如RYGB,糖尿病缓解率和远期EWL较好。上述问题对SG手术的成功率没有影响,但尚需深入探讨以改善其长期预后。尽管如此,SG仍是全美减重手术中最常用的术式,在全球范围内数量也逐渐增加。
RYGB
RYGB是世界上最古老且常用的减重术式之一,已开展30余年。
该术式在近端胃建一个30~40 mL的小胃囊,并将其附着在空肠上,称为Roux肢;另一方面将残胃与十二指肠吻合于回肠,吻合间距一般为50~150 cm,以旷置胃大部和十二指肠。胃旁路通过以下机制发挥作用:首先,与大多数减重手术类似,新建的胃囊要小得多,这种限制性效应有助于减少进食,从而减少卡路里消耗。此外,较小的胃囊导致食物摄入量减少,一部分小肠因缺乏食物而无法吸收热量和营养,因此热量和营养的吸收可能降低。
最重要的是,进食减少会导致肠道激素的变化,促进饱腹感,抑制饥饿感,进而实现减肥和减缓T2DM。与SG相比,RYGB术的长期减重效果和T2DM缓解率稍好。
然而,大量数据表明RYGB手术的早期并发症发生率略高,如感染和出血[22]。此外,RYGB术后约10%左右的患者发生腹内疝。从长期来看,RYGB术后发生维生素B12、叶酸、锌、铁、铜、钙和维生素D等营养物质缺乏的比例略高于SG[23,24]。
与开放性胃转流手术(gastric bypass,GBP)相比,腹腔镜GBP可降低医源性脾切除、伤口感染、切口疝和死亡的发生率;然而,术后早期和长期肠梗阻、胃肠道出血和吻合口狭窄的比例增加[25]。相较于SG,RYGB的并发症发生率极低,因此仍是部分患者和外科医生的首选。
可调节胃束带术
可调节胃束带术(adjustable gastric banding, AGB)是一种减重手术,即在胃的上端放置一个束带。鉴于其远期预后和中长期并发症,该术式受到了外科医生的强烈抨击。45%~60%的患者出现糖尿病缓解;然而,糖尿病的缓解或改善仅是由于体重减轻而缺乏其他机制,这是该术式的主要问题之一,即糖尿病患者和AGB减重失败的患者可能收效甚微。
有文献报道腹腔镜AGB(LAGB)长期减重效果好,然而并未得到大量研究的证实。术后早期患者的EWL可达50%,少数患者可超过60%,然而其远期EWL却低于20% [26]。鉴于较高的并发症发生率和再入院率,目前大多数专家反对LAGB手术,临床很少施行该术式[27,28]。
仍有少数外科医生改良和使用新型胃束带。带状旁路术是胃束带与Roux-en-Y(RNY)旁路手术相结合的新术式之一。该手术旨在降低标准胃旁路术后的远期体重反弹。有研究表明,与传统的旁路手术相比,该术式的远期减重效果更好[29]。
目前胃束带手术尚处于不断的探索中,虽然问题层出但推动了外科医生对于手术和器械的改良进程。
十二指肠开关手术
十二指肠开关手术是一种吸收不良手术,由于其操作复杂和并发症风险高,该术式已较少采用。然而有研究发现,该术式在诱导早期和持续缓解或改善T2DM方面是最有效的(超过85%的EWL与减重无关)。
DS手术可能结合了SG和胃旁路术的部分优势和特色[30,31]。SG是该手术的第一部分,而后行十二指肠横切,在离回盲部250~300 cm处行十二指肠吻合。这一手术结合了限制性和吸收不良两种效应,适用于BMI极高的糖尿病患者。该手术也可采用两步程序,即先施行SG,6~18个月后进行第二步旁路手术。远期EWL维持在80%~100%,糖尿病缓解率在90%左右。然而,中远期的微量元素吸收不良是该手术严重的并发症。有研究表明,与其他手术相比,DS能更好地减重并改善主要并发症;其他研究则指出其并发症和不良事件发生率与RYGB相似[32,33]。
单吻合口胃旁路术(微型胃旁路术)
单吻合口胃旁路术(One anastomosis bypass,OAGB)于2001年首次被报道。该术式重塑管状胃,并将小肠绕过200 cm后近端与管状胃吻合。与RNY胃旁路术相比,微型胃旁路术(mini-Gastric Bypass,MGB)的优点是简单,最大限度地减少了手术时间及相关并发症,远期减重和改善代谢紊乱的效果略好于SG和RYGB。但也可能存在一些并发症,如胆汁反流和溃疡,影响患者的生活质量。另一个关于OAGB的争议是胆胰支的长度。最初OAGB描述的胆胰支长度是200 cm[34,35]。由于对吸收不良的担忧,因此始终缺乏公认的OAGB术中胆胰支长度。目前IFSO已认可了MGB-OAGB手术的有效性和安全性,并将其列为治疗肥胖症与代谢病的手术之一,同时将其术式名称统一为MGB-OAGB [36,37]。
其他术式
单吻合口十二指肠回肠旁路术联合袖状胃切除术(single anastomosis duodenoileal bypass with sleeve gastrectomy,SADI-S)是一种改良的BP分流术。该手术包括SG和胃与小肠之间的吻合术,该吻合口距离回盲瓣250 cm。该术式尤其适用于患有胰岛素依赖性糖尿病和BMI超过50 kg/m2的患者。然而,SADI-S术后可能会出现严重的营养不良[38]。
在过去的十年中,还出现了其他肥胖症与代谢病术式,如SG联合双路转运术(transit bipartition,TB)、单吻合套回肠旁路术(single anastomosis sleeve ileal bypass,SASI)和SG联合回肠转位术。由于以上术式开展较少,对肥胖症和相关疾病的治疗效果仍在评估之中。
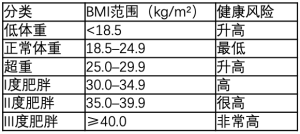
BMI和其他肥胖症分级指标及其局限性
一位比利时数学家和统计学家Lambert Adolphe Jacques Quetelet,在19世纪30年代提出了BMI,即最常见和最实用的体重分类公式。BMI是一个人的体重(kg)除以身高(m)的平方[39](表1)。
Full table
然而,由于BMI不计算肌肉或脂肪的重量,一些特定人群不适合使用BMI,比如,孕妇、老人、幼儿、肌肉发达者,特别是长跑运动员。
此外,最近的数据还显示BMI也没有考虑到不同类型的脂肪,每一种都会对健康产生不同的代谢影响。目前公认的是,肌肉间和器官周围(如肝脏)深处形成的内脏脂肪比皮下脂肪更有害[40,41]。脂肪组织是储存多余能量的主要场所,也是一个内分泌器官。脂肪组织分泌某些激素和其他物质,在能量平衡、免疫力、食欲调节等方面起着重要作用。脂肪组织可分泌炎性介质,这些介质对心血管疾病(cardio vascular disease,CVD)、胰岛素抵抗、T2DM和众多炎性疾病的发展起着重要作用[41]。
体重正常或甚至不足的人可能有较高水平的内脏脂肪。虽然这些人的BMI可能是正常的,但健康问题可能更大。
腰围是评估体重的指标之一,以衡量潜在的体重超标和脂肪堆积,特别用于评估腹部脂肪含量。然而,对应用该指标的效果及其预测未来健康问题的能力很难单独评估,仍需进一步研究[42]。
CT扫描和核磁共振成像可通过区分脂肪与肌肉,更好地显示内脏脂肪。其他类型的扫描,包括双能X射线吸收仪(Dual-energy X-ray absorptiometry,DEXA)图像——一种测量骨密度的常用方法,也可区分脂肪、骨骼和肌肉。尽管上述方法可有效地对肥胖症分级,但费用更高[43]。
减重与代谢:该如何命名?
描述性定义
目前对减重手术和代谢病手术的准确定义仍有争议。减重或肥胖症手术最早定义于1954年实验动物模型和不同类型的小肠切除模型中。研究者试图评估减重的效果,以及部分肠道切除对术后维持或减轻体重的作用[1]。在该实验中,不仅对不同类型的手术进行了定义,而且使我们更详细地了解了这种手术的长期预后。
传统理论认为,减重是由于限制性手术的胃容量减少而导致的热量限制。在吸收不良的情况下,它被认为是由于营养物质吸收不良而导致的。然而,最近的研究表明,可能存在其他几个因素的组合,并对术后的体重减轻很有效。在减重和代谢病手术后,早期(术后几周甚至几天内)糖尿病开始迅速改善,然后才出现体重明显下降。当比较节食与旁路手术的减重效果时发现,手术在改善糖尿病方面效果很明显[44]。上述发现,以及不同的动物模型和激素研究表明,减重与代谢病手术具有众多非体重依赖性降糖作用[45,46]。
在定义了减重与代谢病手术(由于其简单性仍然被广泛使用)后,IFSO建议使用“肥胖症和体重相关疾病的手术”“肥胖症与代谢病手术”作为这些手术的总称。然而,鉴于对降糖机制的研究不断更新,以及考虑用手术来治疗轻度肥胖症甚至超重合并糖尿病的患者日益增多,“代谢病手术”这个概念未来可能仍将被继续使用[47]。
减重与代谢病手术术式的选择
减重手术术式的选择取决于众多因素,如患者的减肥状况和(或)代谢控制需求,患者的偏好,外科医生的专业知识,器械等。然而,对于肥胖症与代谢病手术的不同术式,没有孰优孰略。腹腔镜袖状胃切除术(laparoscopic sleeve gastrectomy,LSG)、腹腔镜胃旁路术(laparoscopic gastric bypass,RYGB)、腹腔镜可调节胃束带术和腹腔镜胆胰转流/十二指肠转换术(laparoscopic biliopancreatic diversion/duodenal switch,BPD-DS)是目前主要的术式。其中,LAGB和BPD-DS应慎重选用。一方面,LAGB术后并发症发生率较高且长期减重效果不佳。另一方面,BPD-DS术后的营养不良风险更高,与该术式中旷置的小肠长度增加有关。而创新的手术术式和概念仍需更多的随机试验和临床研究才能应用于临床。
当前的适应证
随着时间的推移,肥胖症手术指南有何变化?
在过去的几十年里,肥胖症成为一个主要的全球健康问题。可以肯定的是,多年来所有的临床经验和研究都告诉我们,减肥症手术有明确的适应证和禁忌证。
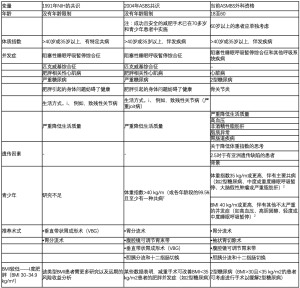
1978年,美国国家卫生研究院(National Institute of Health,NIH)关于肥胖症手术共识会议认为,肠道(空肠)旁路术是肥胖症手术的推荐术式。这种手术虽然被认为是在临床中有效,但也导致了严重的并发症。1978年,接受该术式的患者年龄被限定为50岁以下[48]。
在这次会议之后,NIH在1991年发表了一份关于减重手术的新声明。在该共识会议上,垂直束状胃成形术(Vertical Banded Gastroplasty,VBG)和胃旁路手术成为治疗肥胖症的推荐术式,且不再限制患者年龄。
2004年,ASBS肥胖症与减重手术共识会议发表了关于腹腔镜减重手术优势的新声明[48],2004年所达成的共识指出BMI大于40 kg/m2(或各自年龄段的99.5%)且合并至少一种并发症的青少年患者才考虑行肥胖症手术(表2)。
Full table
2008年,根据欧洲多学科严重肥胖症手术指南,减重手术被认为是对严重的肥胖症患者最有效的治疗方法。2013年,该指南进行了更新并提出该手术的适应证:
- 18~60岁;
- BMI超过40 kg/m2或以上;
- BMI超过35 kg/m2,并有代谢紊乱、心肺疾病、严重关节疾病、与肥胖有关的严重心理问题等并发症[49];
减重手术同样适用于剧烈减肥治疗计划失败后体重复胖的患者。
T2DM是一种可逆性疾病。因此,减重手术是治疗T2DM的有效方法。BMI超过30 kg/m2但低于35 kg/m2的患者仍可考虑该手术。接受减重治疗且体重低于要求的BMI的患者也可进行该手术。
减重手术的禁忌证如下:
- 缺乏医疗看护;
- 精神状态不稳定;
- 严重的抑郁症和(或)人格障碍;
- 酗酒和(或)吸毒成瘾;
- 短期内有生命危险的疾病;
- 不能自理的患者;
- 继发性糖尿病和T2DM抗体阳性(抗GAD或ICA),或C-肽水平低于1 ng/mL或对混合膳食无反应。
代谢病手术
越来越多的证据表明,包括肥胖症手术在内的消化道手术可几乎完全缓解T2DM。T2DM在术后几天即可得到缓解,而此时没有发生明显的体重减轻。针对代谢障碍所进行的手术类型差异较大。目前仍缺乏对与体重减轻无关的T2DM缓解的机制研究。对术后胃肠道的研究表明,肠道激素、微生物菌群等因素导致了T2DM缓解,但仍有很多问题亟待解决,需要广泛讨论。
2007年,第一届糖尿病外科峰会(Diabetes Surgery Summit,DSS)旨在制定利用外科手术治疗T2DM的指南,并为未来的研究奠定基础。许多协会支持这次会议,包括美国糖尿病协会(American Diabetes Association,ADA)、美国代谢和减肥手术协会(American Society for Metabolic and Bariatric Surgery,ASMBS)、IFSO、欧洲糖尿病研究协会(European Association for the Study of Diabetes,EASD),以及其他许多糖尿病和外科协会[50]。
第一届糖尿病外科峰会(DSS-I)定义了消化道手术在严重肥胖症患者(BMI超过35 kg/m2)T2DM治疗中的作用。在I度肥胖症患者(BMI为30~35 kg/m2)中,外科手术也可作为治疗控制不佳的T2DM的替代方法。该报告强调,亟待更多研究来探讨为不太肥胖或超重的患者施行的减重手术。
2015年9月,第二届糖尿病外科峰会(DSS-II)在伦敦举行,再次得到40多个医学和外科协会的认可。在第一届和第二届峰会期间,有众多RCTs证据和高质量的前瞻性研究表明,I度肥胖症患者手术后的早期和远期预后良好。DSS-II指南及其文献综述和专家小组指出,“如果I度肥胖症患者在接受治疗后仍控制不佳,应考虑将代谢病手术作为治疗T2DM的一种选择[51]。”
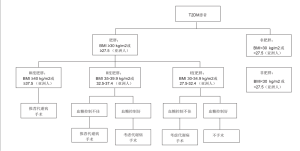
在此之前,医务人员无法坚定地建议患者选择手术来治疗T2DM。DSS-II指南表明,对于符合条件的患者,代谢病手术是一种有效的治疗方法,而在某些情况下更加有效。目前针对T2DM患者的诊疗流程更加清晰合理(图1)。
特殊情况
癌症
减重手术已被证明可以降低某些癌症的发病率,特别是乳腺癌、子宫内膜癌、前列腺癌、结肠直肠癌和胰腺癌等,上述癌症的发生与身体脂肪过多、胰岛素抵抗有关。通过减重手术和改善胰岛素抵抗,上述癌症的发病率下降[52-55]。另一方面,对于患者已经被诊断为癌症并考虑接受肥胖症与代谢病手术,这种情况仍有争议。Gagné等人研究了58名癌症患者,其中40人在术前被确诊,2名患者在术中被确诊,16人在术后被确诊。该研究的结论是,确诊癌症并不是肥胖症与代谢病手术的禁忌证,除非癌症没有得到控制而且有复发和转移的风险[56]。然而,文献中没有关于上述问题的研究。
慢性肝衰竭
非酒精性脂肪肝(non alcoholic fatty liver disease,NAFLD)在临床和病理学上从简单的脂肪肝到肝硬化不等。NAFLD出现炎症时的阶段被称为非酒精性脂肪性肝炎(non-alcoholic steatohepatitis,NAFH)。这些情况通常发生于没有酗酒史的患者[57]。NAFLD影响着全球25%的成年人口,其死亡率不断上升[58]。
美国胃肠病协会、美国肝病研究协会和美国胃肠病学院的实践指南建议,对于肥胖症和非酒精性脂肪肝或NASH患者,减重手术并不是禁忌证,除非已确诊为肝硬化。该指南的结论是,减重手术尚无法作为NASH的治疗方法[59]。一项大型的Meta分析显示,减重手术可改善大多数患者的脂肪变性和脂肪性肝炎,并改善30%患者的肝纤维化问题[60]。
据Laursen等人报告,随着减重手术显著改善GLP-1和其他肠道激素、重要物质代谢、炎症等方面,该手术可能会逆转NAFLD和NASH患者的肝脏病理变化。但该成果仍需长期随访的大型随机临床试验进行验证,以明确减重手术对NAFLD和NASH患者的作用[61]。
精神疾病
精神健康十分重要,在肥胖症与代谢病手术前需明确。术前应进行精神病相关问诊,并进行详细的精神病学检查。由于肥胖症与代谢病手术后的解剖学和激素变化,患者应在术前对上述变化做好心理准备,并在日常生活上做出相应调整。
众所周知,有些精神疾病是手术的禁忌证,而在其他情况下,通过适当的治疗可以进行手术。严重的、未经治疗的双相情感障碍[62],精神分裂症和精神病是手术的绝对禁忌证。此外,术前应评估有无药物或酒精滥用、贪食症,这些疾病有可能增加术后并发症的发生率,也应被列为绝对禁忌证。经过治疗且症状出现缓解后,患者可重新接受精神病相关检查,以评估是否可以手术[63]。在任何情况下都应告知患者及其家属在术后可能会出现精神症状加重。目前尚不清楚上述问题是正常的疾病进展,还是手术导致的[64]。
另一个问题是肥胖症与代谢病手术导致的“手术减重”。研究表明,情绪和焦虑症、暴饮暴食症和夜食综合征对术后的最终减重效果可能有负面影响。在术前和术后采用多学科团队综合评估上述疾病,以实现合理有效的减重[49,53,65](表3)。

Full table
结论
自腹腔镜应用于减重手术,肥胖症与代谢病手术飞速发展,并发症更少,减重效果更好。
特别是在过去的十年中,众多随机对照研究、各种减重与代谢病协会发布的指南促进了代谢病手术的发展,并进一步得到了有力的论证。随着对这些手术效果的了解,外科医生和研究人员对该手术更加充满信心。
然而,随着层出不穷的新研究结果的出现和世界人口健康问题的变化,未来仍需更多的研究以提升该手术的预后效果,减少并发症。
Acknowledgments
Funding: None.
Footnote
Provenance and Peer Review: This article was commissioned by the Guest Editor (Mehmet Mahir Ozmen) for the series “Bariatric and Metabolic Surgery” published in Annals of Laparoscopic and Endoscopic Surgery. The article was sent for external peer review organized by the Guest Editor and the editorial office.
Conflicts of Interest: Both authors have completed the ICMJE uniform disclosure form (available at http://dx.doi.org/10.21037/ales-20-52). The series “Bariatric and Metabolic Surgery” was commissioned by the editorial office without any funding or sponsorship. The authors have no other conflicts of interest to declare.
Ethical Statement: The authors are accountable for all aspects of the work in ensuring that questions related to the accuracy or integrity of any part of the work are appropriately investigated and resolved.
Open Access Statement: This is an Open Access article distributed in accordance with the Creative Commons Attribution-NonCommercial-NoDerivs 4.0 International License (CC BY-NC-ND 4.0), which permits the non-commercial replication and distribution of the article with the strict proviso that no changes or edits are made and the original work is properly cited (including links to both the formal publication through the relevant DOI and the license). See: https://creativecommons.org/licenses/by-nc-nd/4.0/.
References
- Kremen AJ, Linner JH, Nelson CH. An experimental evaluation of the nutritional importance of proximal and distal small intestine. Ann Surg 1954;140:439-48. [Crossref] [PubMed]
- Mason EE, Ito C. Gastric bypass in obesity. Surg Clin North Am 1967;47:1345-51. [Crossref] [PubMed]
- Griffen WO Jr, Young VL, Stevenson CC. A prospective comparison of gastric and jejunoileal bypass procedures for morbid obesity. Ann Surg 1977;186:500-9. [Crossref] [PubMed]
- Wittgrove AC, Clark GW, Tremblay LJ. Laparoscopic Gastric Bypass, Roux-en-Y: Preliminary Report of Five Cases. Obes Surg 1994;4:353-7. [Crossref] [PubMed]
- Fobi MA, Fleming AW. Vertical banded gastroplasty vs gastric bypass in the treatment of obesity. J Natl Med Assoc 1986;78:1091-8. [PubMed]
- Mason EE. Vertical banded gastroplasty for obesity. Arch Surg 1982;117:701-6. [Crossref] [PubMed]
- Kuzmak LI. A Review of Seven Years' Experience with Silicone Gastric Banding. Obes Surg 1991;1:403-8. [Crossref] [PubMed]
- Madsbad S, Dirksen C, Holst JJ. Mechanisms of changes in glucose metabolism and bodyweight after bariatric surgery. Lancet Diabetes Endocrinol 2014;2:152-64. [Crossref] [PubMed]
- Rubino F, Nathan DM, Eckel RH, et al. Metabolic Surgery in the Treatment Algorithm for Type 2 Diabetes: A Joint Statement by International Diabetes Organizations. Diabetes Care 2016;39:861-77. [Crossref] [PubMed]
- Mechanick JI, Youdim A, Jones DB, et al. Clinical practice guidelines for the perioperative nutritional, metabolic, and nonsurgical support of the bariatric surgery patient--2013 update: cosponsored by American Association of Clinical Endocrinologists, the Obesity Society, and American Society for Metabolic & Bariatric Surgery. Endocr Pract 2013;19:337-72. [Crossref] [PubMed]
- Ng M, Fleming T, Robinson M, et al. Global, regional, and national prevalence of overweight and obesity in children and adults during 1980-2013: a systematic analysis for the Global Burden of Disease Study 2013. Lancet 2014;384:766-81. [Crossref] [PubMed]
- Vasileva LV, Marchev AS, Georgiev MI. Causes and solutions to "globesity": The new fa(s)t alarming global epidemic. Food Chem Toxicol 2018;121:173-93. [Crossref] [PubMed]
- Angrisani L, Santonicola A, Iovino P, et al. Bariatric Surgery Worldwide 2013. Obes Surg 2015;25:1822-32. [Crossref] [PubMed]
- English WJ, DeMaria EJ, Brethauer SA, et al. American Society for Metabolic and Bariatric Surgery estimation of metabolic and bariatric procedures performed in the United States in 2016. Surg Obes Relat Dis 2018;14:259-63. [Crossref] [PubMed]
- Young MT, Gebhart A, Phelan MJ, et al. Use and Outcomes of Laparoscopic Sleeve Gastrectomy vs Laparoscopic Gastric Bypass: Analysis of the American College of Surgeons NSQIP. J Am Coll Surg 2015;220:880-5. [Crossref] [PubMed]
- Himpens J, Dobbeleir J, Peeters G. Long-term results of laparoscopic sleeve gastrectomy for obesity. Ann Surg 2010;252:319-24. [Crossref] [PubMed]
- Howard DD, Caban AM, Cendan JC, et al. Gastroesophageal reflux after sleeve gastrectomy in morbidly obese patients. Surg Obes Relat Dis 2011;7:709-13. [Crossref] [PubMed]
- de Jong JR, Besselink MG, van Ramshorst B, et al. Effects of adjustable gastric banding on gastroesophageal reflux and esophageal motility: a systematic review. Obes Rev 2010;11:297-305. [Crossref] [PubMed]
- Woodman G, Cywes R, Billy H, et al. Effect of adjustable gastric banding on changes in gastroesophageal reflux disease (GERD) and quality of life. Curr Med Res Opin 2012;28:581-9. [Crossref] [PubMed]
- Golomb I, Ben David M, Glass A, et al. Long-term Metabolic Effects of Laparoscopic Sleeve Gastrectomy. JAMA Surg 2015;150:1051-7. [Crossref] [PubMed]
- Hoyuela C. Five-year outcomes of laparoscopic sleeve gastrectomy as a primary procedure for morbid obesity: A prospective study. World J Gastrointest Surg 2017;9:109-17. [Crossref] [PubMed]
- Lager CJ, Esfandiari NH, Subauste AR, et al. Roux-En-Y Gastric Bypass Vs. Sleeve Gastrectomy: Balancing the Risks of Surgery with the Benefits of Weight Loss. Obes Surg 2017;27:154-61. [Crossref] [PubMed]
- Bloomberg RD, Fleishman A, Nalle JE, et al. Nutritional deficiencies following bariatric surgery: what have we learned? Obes Surg 2005;15:145-54. [Crossref] [PubMed]
- Goldner WS, Stoner JA, Lyden E, et al. Finding the optimal dose of vitamin D following Roux-en-Y gastric bypass: a prospective, randomized pilot clinical trial. Obes Surg 2009;19:173-9. [Crossref] [PubMed]
- Podnos YD, Jimenez JC, Wilson SE, et al. Complications after laparoscopic gastric bypass: a review of 3464 cases. Arch Surg 2003;138:957-61. [Crossref] [PubMed]
- Suter M, Calmes JM, Paroz A, et al. A 10-year experience with laparoscopic gastric banding for morbid obesity: high long-term complication and failure rates. Obes Surg 2006;16:829-35. [Crossref] [PubMed]
- Aarts EO, Dogan K, Koehestanie P, et al. Long-term results after laparoscopic adjustable gastric banding: a mean fourteen year follow-up study. Surg Obes Relat Dis 2014;10:633-40. [Crossref] [PubMed]
- Himpens J, Cadiere GB, Bazi M, et al. Long-term outcomes of laparoscopic adjustable gastric banding. Arch Surg 2011;146:802-7. [Crossref] [PubMed]
- Lemmens L. Banded Gastric Bypass: Better Long-Term Results? A Cohort Study with Minimum 5-Year Follow-Up. Obes Surg 2017;27:864-72. [Crossref] [PubMed]
- Baltasar A, Bou R, Bengochea M, et al. Duodenal switch: an effective therapy for morbid obesity--intermediate results. Obes Surg 2001;11:54-8. [Crossref] [PubMed]
- Marceau P, Biron S, Hould FS, et al. Duodenal switch: long-term results. Obes Surg 2007;17:1421-30. [Crossref] [PubMed]
- Biertho L, Simon-Hould F, Marceau S, et al. Current Outcomes of Laparoscopic Duodenal Switch. Ann Surg Innov Res 2016;10:1. [Crossref] [PubMed]
- Dorman RB, Rasmus NF, al-Haddad BJ, et al. Benefits and complications of the duodenal switch/biliopancreatic diversion compared to the Roux-en-Y gastric bypass. Surgery 2012;152:758-65. [Crossref] [PubMed]
- Bollig CA, Gilley D, Lesko D, et al. Economic Impact of Frozen Section for Thyroid Nodules with "Suspicious for Malignancy" Cytology. Otolaryngol Head Neck Surg 2018;158:257-64. [Crossref] [PubMed]
- Rutledge R. The mini-gastric bypass: experience with the first 1,274 cases. Obes Surg 2001;11:276-80. [Crossref] [PubMed]
- De Luca M, Tie T, Ooi G, et al. Mini Gastric Bypass-One Anastomosis Gastric Bypass (MGB-OAGB)-IFSO Position Statement. Obes Surg 2018;28:1188-206. [Crossref] [PubMed]
- Mahawar KK, Himpens J, Shikora SA, et al. The First Consensus Statement on One Anastomosis/Mini Gastric Bypass (OAGB/MGB) Using a Modified Delphi Approach. Obes Surg 2018;28:303-12. [Crossref] [PubMed]
- Shoar S, Poliakin L, Rubenstein R, et al. Single Anastomosis Duodeno-Ileal Switch (SADIS): A Systematic Review of Efficacy and Safety. Obes Surg 2018;28:104-13. [Crossref] [PubMed]
- Obesity: preventing and managing the global epidemic. Report of a WHO Consultation (WHO Technical Report Series 894). World Health Organization, 2000.
- Ahima RS, Lazar MA. Physiology. The health risk of obesity--better metrics imperative. Science 2013;341:856-8. [Crossref] [PubMed]
- Coelho M, Oliveira T, Fernandes R. Biochemistry of adipose tissue: an endocrine organ. Arch Med Sci 2013;9:191-200. [Crossref] [PubMed]
- Grievink L, Alberts JF, O'Niel J, G, et al. Waist circumference as a measurement of obesity in the Netherlands Antilles; associations with hypertension and diabetes mellitus. Eur J Clin Nutr 2004;58:1159-65. [Crossref] [PubMed]
- Kim YJ, Lee SH, Kim TY, et al. Body fat assessment method using CT images with separation mask algorithm. J Digit Imaging 2013;26:155-62. [Crossref] [PubMed]
- Cummings DE, Rubino F. Metabolic surgery for the treatment of type 2 diabetes in obese individuals. Diabetologia 2018;61:257-64. [Crossref] [PubMed]
- Ikramuddin S, Korner J, Lee WJ, et al. Roux-en-Y gastric bypass vs intensive medical management for the control of type 2 diabetes, hypertension, and hyperlipidemia: the Diabetes Surgery Study randomized clinical trial. JAMA 2013;309:2240-9. [Crossref] [PubMed]
- Schauer PR, Bhatt DL, Kashyap SR. Bariatric surgery versus intensive medical therapy for diabetes. N Engl J Med 2014;371:682. [Crossref] [PubMed]
- Cummings DE, Cohen RV. Beyond BMI: the need for new guidelines governing the use of bariatric and metabolic surgery. Lancet Diabetes Endocrinol 2014;2:175-81. [Crossref] [PubMed]
- 2004 ASBS Consensus Conference on Surgery for Severe Obesity. Surg Obes Relat Dis 2005;1:297-381. [PubMed]
- Fried M, Yumuk V, Oppert JM, et al. Interdisciplinary European guidelines on metabolic and bariatric surgery. Obes Surg 2014;24:42-55. [Crossref] [PubMed]
- Rubino F, Kaplan LM, Schauer PR, et al. The Diabetes Surgery Summit consensus conference: recommendations for the evaluation and use of gastrointestinal surgery to treat type 2 diabetes mellitus. Ann Surg 2010;251:399-405. [Crossref] [PubMed]
- Cohen RV, Shikora S, Petry T, et al. The Diabetes Surgery Summit II Guidelines: a Disease-Based Clinical Recommendation. Obes Surg 2016;26:1989-91. [Crossref] [PubMed]
- Pontiroli AE, Ceriani V, Sarro G, et al. Incidence of Diabetes Mellitus, Cardiovascular Diseases, and Cancer in Patients Undergoing Malabsorptive Surgery (Biliopancreatic Diversion and Biliointestinal Bypass) vs Medical Treatment. Obes Surg 2019;29:935-42. [Crossref] [PubMed]
- De Luca M, Angrisani L, Himpens J, et al. Indications for Surgery for Obesity and Weight-Related Diseases: Position Statements from the International Federation for the Surgery of Obesity and Metabolic Disorders (IFSO). Obes Surg 2016;26:1659-96. [Crossref] [PubMed]
- Winder AA, Kularatna M, MacCormick AD. Does Bariatric Surgery Affect the Incidence of Breast Cancer Development? A Systematic Review. Obes Surg 2017;27:3014-20. [Crossref] [PubMed]
- Winder AA, Kularatna M, MacCormick AD. Does Bariatric Surgery Affect the Incidence of Endometrial Cancer Development? A Systematic Review. Obes Surg 2018;28:1433-40. [Crossref] [PubMed]
- Gagné DJ, Papasavas PK, Maalouf M, et al. Obesity surgery and malignancy: our experience after 1500 cases. Surg Obes Relat Dis 2009;5:160-4. [Crossref] [PubMed]
- Younossi ZM, Marchesini G, Pinto-Cortez H, et al. Epidemiology of Nonalcoholic Fatty Liver Disease and Nonalcoholic Steatohepatitis: Implications for Liver Transplantation. Transplantation 2019;103:22-7. [Crossref] [PubMed]
- Younossi ZM. Non-alcoholic fatty liver disease - A global public health perspective. J Hepatol 2019;70:531-44. [Crossref] [PubMed]
- Chalasani N, Younossi Z, Lavine JE, et al. The diagnosis and management of non-alcoholic fatty liver disease: practice guideline by the American Gastroenterological Association, American Association for the Study of Liver Diseases, and American College of Gastroenterology. Gastroenterology 2012;142:1592-609. [Crossref] [PubMed]
- Fakhry TK, Mhaskar R, Schwitalla T, et al. Bariatric surgery improves nonalcoholic fatty liver disease: a contemporary systematic review and meta-analysis. Surg Obes Relat Dis 2019;15:502-11. [Crossref] [PubMed]
- Laursen TL, Hagemann CA, Wei C, et al. Bariatric surgery in patients with non-alcoholic fatty liver disease - from pathophysiology to clinical effects. World J Hepatol 2019;11:138-49. [Crossref] [PubMed]
- Bauchowitz AU, Gonder-Frederick LA, Olbrisch ME, et al. Psychosocial evaluation of bariatric surgery candidates: a survey of present practices. Psychosom Med 2005;67:825-32. [Crossref] [PubMed]
- Friedman KE, Applegate K, Portenier D, et al. Bariatric surgery in patients with bipolar spectrum disorders: Selection factors, postoperative visit attendance, and weight outcomes. Surg Obes Relat Dis 2017;13:643-51. [Crossref] [PubMed]
- Shelby SR, Labott S, Stout RA. Bariatric surgery: a viable treatment option for patients with severe mental illness. Surg Obes Relat Dis 2015;11:1342-8. [Crossref] [PubMed]
- de Zwaan M, Enderle J, Wagner S, et al. Anxiety and depression in bariatric surgery patients: a prospective, follow-up study using structured clinical interviews. J Affect Disord 2011;133:61-8. [Crossref] [PubMed]

王子杰
南京医科大学第一附属医院(江苏省人民医院)。医学博士,南京医科大学第一附属医院(江苏省人民医院)泌尿外科主治医师。长期从事泌尿外科相关临床与基础研究。近五年先后以第一作者或共同第一作者身份发表SCI二十余篇,主持国家级和省级课题两项。(更新时间:2021/8/24)
(本译文仅供学术交流,实际内容请以英文原文为准。)
Cite this article as: Dilektasli E, Demir B. Definitions and current indications for obesity and metabolic surgery. Ann Laparosc Endosc Surg 2021;6:8.